|
Por Cristiane Albuquerque
Em março de 1930, uma espécie de mosquito jamais antes vista na América foi encontrada no litoral brasileiro. Apesar da má fama, o inseto – conhecido por transmitir a forma mais letal da malária no continente africano – não atraiu de imediato os holofotes do governo brasileiro e de organismos internacionais com atuação no país na época. Com as atenções voltadas para o combate à febre amarela no Rio de Janeiro, autoridades federais e a Fundação Rockefeller deixaram o mosquito Anopheles gambiae de fora de suas listas de prioridades.
As consequências da falta de resposta foram graves. Depois de um surto de malária localizada na capital do Rio Grande do Norte, o mosquito se alastrou silenciosamente pelo interior do estado e do vizinho Ceará entre 1932 e 1937, causando uma epidemia na região. Esse cenário é revelado por estudos conduzidos pelo historiador Gabriel Lopes, da Casa de Oswaldo Cruz, compilados no livro O Feroz Mosquito Africano no Brasil: o Anopheles gambiae entre o silêncio e a sua erradicação (1930-1940), lançado este mês pela Editora Fiocruz.
Um estudo sobre a chegada do A. gambiae e seu alastramento tenha sido iniciado no começo de 1930 pelo pesquisador Raymond Shannon, especialista em insetos do Serviço Cooperativo de Febre Amarela (SCFA) da Fundação Rockfeller. A pesquisa, porém, foi interrompida com a descoberta do ciclo silvestre da febre amarela, que fez os casos da doença retornarem ao Rio de Janeiro no final dos anos de 1920, depois de sua erradicação no começo do século 20.
 |
Shannon foi o responsável pela identificação da espécie em Natal. Após uma breve pesquisa sobre as novas rotas de navios e hidroaviões em circulação, descobriu que o mosquito tinha como provável origem a cidade de Dacar, capital do Senegal. “O Anopheles gambiae foi ofuscado pela preocupação com os casos de febre amarela que aconteceram no Rio de Janeiro, [então] capital federal, em 1928 e 1929. O foco da Fundação Rockefeller era o Aedes aegypti, vetor da doença. Nessas circunstâncias, o controle da febre amarela tinha prioridade sobre qualquer outro problema de saúde”, afirma Lopes.
Meses após a chegada do Anopheles gambiae ao Brasil, um surto de malária, restrito a um bairro de Natal com 12 mil habitantes, registrou 10 mil casos da enfermidade. Doença infecciosa, febril e potencialmente grave, a malária é causada pelo parasita do gênero Plasmodium, transmitido ao homem, pela picada da fêmea de mosquitos do gênero Anopheles infectados. Diante do desafio do surto causado pela presença do inseto e o consequente aumento do número de óbitos, o governador do estado, Juvenal Lamartine de Faria, recorreu à Fundação Rockefeller para que auxiliasse no combate ao novo mosquito.
O Anopheles gambiae foi ofuscado pela preocupação com os casos de febre amarela que aconteceram no Rio de Janeiro, [então] capital federal, em 1928 e 1929
Ainda que o vetor da malária não fosse prioridade do Serviço Cooperativo de Febre Amarela (SCFA) da Fundação, a atuação da instituição foi fundamental, aponta o pesquisador. “A ação emergencial em Natal com utilização de métodos usuais de profilaxia e de combate às larvas do A. gambiae foi bem-sucedida. No entanto, tratado de maneira paliativa, o mosquito se espalhou, posteriormente, pelo interior, uma vez que não era a área de atuação do SCFA”, salienta Lopes, pesquisador em estágio pós-doutoral na Casa de Oswaldo Cruz.
Discutida pelas autoridades sanitárias federais em junho e, novamente, em setembro de 1930, as medidas emergenciais de combate ao mosquito foram prejudicadas devido à instabilidade política no Rio Grande do Norte, que sofria com uma constante troca de interventores. Em janeiro de 1931, Natal foi assolada pela segunda epidemia da doença. “Em março de 1931, foram iniciadas ações com a utilização do método de pulverização de inseticida nas residências que contribuíram para que o para que o mosquito fosse expulso da cidade”, afirma Lopes.
No Brasil, de acordo com o Ministério da Saúde, a região amazônica concentra 99% dos casos de malária. De janeiro a março do ano passado, foram notificados quase 32 mil novos casos da doença no país, segundo o órgão. Atualmente, o Anopheles darlingi é o mais frequente transmissor da doença na Amazônia brasileira. Cerca de 400 mil pessoas morrem de malária por ano, sendo que aproximadamente 3 bilhões estão sob risco de contrair a doença, indica a Organização Mundial da Saúde (OMS). Mais de 90% dos casos atingem populações negligenciadas da África subsaariana.
Alastramento silencioso
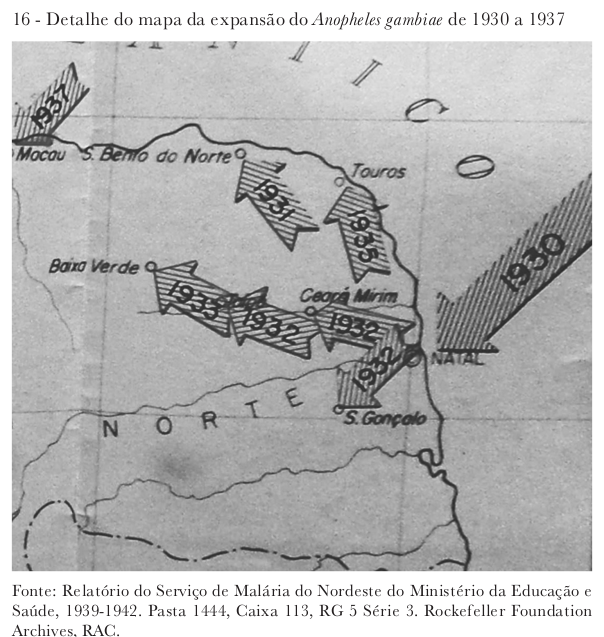
Com a eliminação do A. gambiae de Natal, em 1932, as autoridades públicas passaram a negligenciar a presença do vetor, já que os casos de malária haviam sido controlados. A falta de monitoramento favoreceu o perigoso alastramento do mosquito para o interior do Rio Grande do Norte e para o Ceará. O Anopheles gambiae avançou até Mossoró, espalhando-se por todo o litoral norte do estado até a Serra do Apodí. No Ceará, estendeu-se pelo vale do Jaguaribe até Jaguaribe-mirim, desde o litoral. Entre 1932 e 1937, o vetor e a doença permaneceram ignorados. Somente em março de 1938 a epidemia tornou visível a presença de um mosquito até então “invisível”, embora estivesse presente em território nacional desde 1930.
 |
O alastramento e a gravidade da epidemia provocada pelo Anopheles gambiae tinham relação com as condições sociais e políticas da região. “A precariedade das condições de vida da maior parte da população atingida, a falta de organização da saúde pública e os revezes políticos, com a intervenção autoritária do início da Era Vargas, fizeram com que as ações da Fundação Rockefeller com o A. gambiae no Rio Grande do Norte ficassem ainda mais limitadas”, analisa Lopes.
Com a eliminação do A. gambiae de Natal, em 1932, as autoridades públicas passaram a negligenciar a presença do vetor, já que os casos de malária haviam sido controlados. A falta de monitoramento favoreceu o perigoso alastramento do mosquito para o interior do Rio Grande do Norte e para o Ceará
Além do contexto de negligência, o Anopheles gambiae encontrou condições naturais ideais para seu desenvolvimento na região. A influência das estações de seca e chuva na proliferação do mosquito favoreceram seu estabelecimento no território. “As secas que ocorreram entre 1932 e 1937, o comportamento e a adaptação ao novo ambiente contribuíram para que a propagação, mesmo que de forma silenciosa e invisível, culminasse em uma grande epidemia em 1938, com significativo número de mortes por malária”, observa Lopes.
Em maio de 1938, mais de 100 mil pessoas estavam em tratamento nas regiões atingidas. O Rio Grande do Norte, então com 240 mil habitantes, registrou 50 mil casos de malária e 5 mil mortes pela doença. Já na cidade de Russas, no Ceará, em que ocorriam cerca de 200 mortes anuais, foram registrados cerca de 14 mil óbitos por malária de janeiro a agosto de 1938. “Em algumas cidades do interior, cerca de 90% das pessoas foram acometidas pela malária grave. Famílias inteiras foram atingidas e não tinham forças buscar ajuda nas cidades próximas, por exemplo”, afirma o historiador.
Foi neste contexto que o combate ao Anopheles gambiae ganhou uma nova abordagem após a era “silenciosa”. Sua comprovada capacidade de se alastrar e causar danos irreparáveis a populações inteiras, associada a preocupações de saúde pública internacional, motivaram maior atenção ao mosquito. Para montar o quebra-cabeça do alastramento silencioso e compreender o padrão A. gambiae após a grande epidemia de 1938, houve uma integração entre cientistas brasileiros e norte-americanos. Na tentativa de solucionar o problema, foi criado o Serviço de Malária do Nordeste (SMNE), em 1939, uma cooperação entre a Fundação Rockefeller e o governo brasileiro.
A Fundação Rockefeller mudou sua estratégia de atuação e, em 1939, entregou o Serviço Cooperativo de Febre Amarela (SCFA) ao governo brasileiro. Com a vantagem de ter uma estrutura de atuação eficiente, o SCFA foi adaptado para lidar com o A. gambiae no Serviço de Malária do Nordeste. “A Fundação Rockefeller tinha por princípio atuar em parceria com os governos e buscava garantir o que chamava de efeito de demonstração em saúde pública, uma atuação que pudesse mostrar eficiência em ações pontuais que pudessem ser mensuráveis e reproduzidas. Nesse período, o Anopheles gambiae passou a ser considerado um objeto exemplar para a sua demonstração”, explicou o historiador.
A epidemia de malária de 1938 tinha um grande apelo e foi utilizada por Fred Soper, responsável pelo Serviço Cooperativo de Febre Amarela, como forma de tornar visível seu projeto de extermínio de mosquitos. O A. gambiae foi eleito, então, um alvo perfeito, pois segundo os estudos de Raymond Shannon, o mosquito tinha uma baixa reprodução nos períodos de seca, o que tornaria mais fácil a sua eliminação.
“Para convencer as autoridades que projeto de extermínio do mosquito africano era urgente, Soper buscou, mostrar que o A. gambiae era um grande perigo para as Américas, talvez um perigo maior que o próprio Aedes aegypti, vetor da febre amarela”, ressalta Lopes.
Epidemia, controvérsias científicas e disputas
Em 1940, o Anopheles gambiae foi erradicado e ganhou visibilidade a fim de comprovar que as técnicas adotadas pelo Serviço de Malária do Nordeste eram eficientes. A referência “feroz mosquito africano”, feita pelo médico, político e ensaísta Afrânio Peixoto, exaltava a vitória da ciência e da medicina brasileiras contra o mosquito.
A formação do Serviço de Malária do Nordeste (SMNE) causou, no entanto, controvérsias científicas e disputas entre a Fundação Rockefeller e autoridades brasileiras de saúde: o SMNE era, sobretudo, uma operação de extermínio do A. gambiae, e a atuação do cientista Evandro Chagas em investigações paralelas sobre o mosquito no Ceará colocou o projeto do pesquisador em oposição à iniciativa de erradicação do mosquito. O cientista, que atuava no Serviço de Estudos de Grandes Endemias (Sege) e tinha articulação com Serviço Cooperativo de Febre Amarela, se aproximou do Serviço de Malária do Nordeste (SMNE).
Na época, Evandro Chagas realizava experimentos com uma droga sintética contra a malária, chamada atebrina, de um laboratório alemão, e estabeleceu uma cooperação com o SMNE para ter sítios de pesquisa no interior do Ceará. Nesses locais, mantinha criadouros de A. gambiae para experimentos com a atebrina e o uso de inseticidas no interior das casas, um método desenvolvido pelo seu pai, Carlos Chagas, para combater a febre amarela no Rio no início do século 20.
|
|
|
Médico e cientista Evandro Chagas. Foto: Acervo COC/Fiocruz. |
A iniciativa, no entanto, conflitou com o programa de erradicação do A. gambiae defendido pela Fundação Rockfeller: os mosquitos mantidos nos criadouros de Evandro Chagas voavam para as áreas adjacentes, causando a reinfestação de locais considerados livres de A. gambiae.
“A incapacidade de conter o mosquito para servir aos experimentos e o rápido extermínio do vetor na época das secas, por parte do SMNE, fizeram com que os experimentos de Chagas se tornassem mais difíceis. Posteriormente, com o avanço da eliminação do A. gambiae na região, o cientistas interrompeu sua pesquisa”, diz Lopes.
Com uma estratégia voltada aos hábitos de reprodução como o A. gambiae se adaptava ao ambiente, buscou-se atacar os criadouros preferenciais do mosquito: poças de água rasa expostas ao sol. Em 1940, o Anopheles gambiae foi erradicado e ganhou visibilidade a fim de comprovar que as técnicas adotadas pelo Serviço de Malária do Nordeste eram eficientes. A referência “feroz mosquito africano”, feita pelo médico, político e ensaísta Afrânio Peixoto, exaltava a vitória da ciência e da medicina brasileiras contra o mosquito.
“Antes de ser escolhido para demonstrar um feito sanitário de erradicação, o Anopheles gambiae ficou quase oito anos longe das prioridades de saúde pública, e a erradicação foi comemorada como um grande feito em saúde pública”, explica Lopes.
Após a erradicação do Anopheles gambiae, durante a Segunda Guerra Mundial, mosquitos dessa espécie vindos do continente africano foram encontrados novamente no Rio Grande do Norte. O estado abrigou a maior base norte-americana fora dos EUA, conhecida como Parnamirim Field, que funcionava como pouso para os aviões que se destinavam ao continente. “Nessa época, a vigilância sanitária dos aeroportos era muito mais rígida que no início dos anos de 1930, e o mosquito não voltou a infestar a região”, conclui Lopes.



 Arte: Silmara Mansur
Arte: Silmara Mansur


